Enews200 利用質譜儀進行後轉譯修飾的偵測
出自KMU e-News
(新頁面: 高雄醫學大學e快報 第200期 研究資源整合發展中心專題 == '''利用質譜儀進行後轉譯修飾(Post-translational modification)的偵測''' == 研究資源整...) |
|||
| 第20行: | 第20行: | ||
若是已知蛋白質,在已知胺基酸的序列下,為了使質譜儀對於peptide的偵測更有效率,可以將知質荷比(m/z) peptide輸入控制質譜儀的電腦中,一旦偵測到相同的質荷比,即可以強制選擇該離子,進入二次離子的掃描模式中,一來可以避免其他高濃度peptide的干擾,二來可以增加二次離子的訊號強度。質譜儀廠商亦開發出相關的軟體可供使用,如AB SCIEX 的MIDAS與Thermo 的Pinpoint軟體。這二類軟體可以藉由輸入已知蛋白質的序列,推估使用胰蛋白酶消化後並加上磷酸根之後的質荷比,軟體介面如圖一所示。 | 若是已知蛋白質,在已知胺基酸的序列下,為了使質譜儀對於peptide的偵測更有效率,可以將知質荷比(m/z) peptide輸入控制質譜儀的電腦中,一旦偵測到相同的質荷比,即可以強制選擇該離子,進入二次離子的掃描模式中,一來可以避免其他高濃度peptide的干擾,二來可以增加二次離子的訊號強度。質譜儀廠商亦開發出相關的軟體可供使用,如AB SCIEX 的MIDAS與Thermo 的Pinpoint軟體。這二類軟體可以藉由輸入已知蛋白質的序列,推估使用胰蛋白酶消化後並加上磷酸根之後的質荷比,軟體介面如圖一所示。 | ||
| + | [[Image:enews200專題3-1.jpg|400px]] | ||
| + | 圖一,將已知蛋白質的胺基酸序列輸入,並選擇消化酵素與後轉譯修飾,軟體將呈現peptide的質荷比。 | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | 圖一,將已知蛋白質的胺基酸序列輸入,並選擇消化酵素與後轉譯修飾,軟體將 | ||
| - | 呈現peptide的質荷比。 | ||
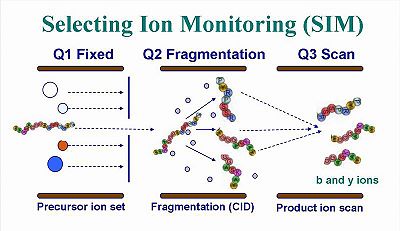
將所得訊息輸入控制質譜儀器的電腦待以鑑定分析的離子,而實際質譜儀的運作模式如下:樣品經由HPLC管柱持續分離而進入串聯質譜譜進行全掃描分析,而只有符合設定的質荷比分子才會進入後段質譜儀進行碰撞裂解(CID)與子離子掃描,所以,分析的離子只鎖定符合的離子,而將其他非相關離子排除,其分析模式如圖二所示,在質譜儀應用上,該方法名為selected ion monitoring (SIM)。 | 將所得訊息輸入控制質譜儀器的電腦待以鑑定分析的離子,而實際質譜儀的運作模式如下:樣品經由HPLC管柱持續分離而進入串聯質譜譜進行全掃描分析,而只有符合設定的質荷比分子才會進入後段質譜儀進行碰撞裂解(CID)與子離子掃描,所以,分析的離子只鎖定符合的離子,而將其他非相關離子排除,其分析模式如圖二所示,在質譜儀應用上,該方法名為selected ion monitoring (SIM)。 | ||
| + | [[Image:enews200專題3-2.jpg|400px]] | ||
| + | 圖二,selecting ion monitoring的分析模式。第一段質譜只能通過特定質荷比的離子進入第二段質譜進行裂解,第三段質譜再進行子離子的全掃描。 | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | 圖二,selecting ion monitoring的分析模式。第一段質譜只能通過特定質荷比的離子進入第二段質譜進行裂解,第三段質譜再進行子離子的全掃描。 | ||
由上述簡略的說明中可得知,蛋白質體的研究發展,涉及到後轉譯修飾,將不僅單靠生物化學家的實驗室進行分析,尚需依賴萃取濃縮的技術(分析方法)、質譜儀器的進步(機電設計)與統整的分析策略(跨領域)。近十年來,蛋白體的研究,已經由定性分析慢慢進入定量分析,藉由早期研究所累積下來眾多具有潛力的蛋白質群體,將開始進行大規模的確效與驗證。所以,能夠分析更稀少的樣品、能縮短時間與減少人力卻得到更多的資訊,將是未來努力的目標。 | 由上述簡略的說明中可得知,蛋白質體的研究發展,涉及到後轉譯修飾,將不僅單靠生物化學家的實驗室進行分析,尚需依賴萃取濃縮的技術(分析方法)、質譜儀器的進步(機電設計)與統整的分析策略(跨領域)。近十年來,蛋白體的研究,已經由定性分析慢慢進入定量分析,藉由早期研究所累積下來眾多具有潛力的蛋白質群體,將開始進行大規模的確效與驗證。所以,能夠分析更稀少的樣品、能縮短時間與減少人力卻得到更多的資訊,將是未來努力的目標。 | ||
在2012年5月23日 (三) 11:11所做的修訂版本
高雄醫學大學e快報 第200期 研究資源整合發展中心專題
利用質譜儀進行後轉譯修飾(Post-translational modification)的偵測
研究資源整合發展中心 發展企劃組 梁世欣組長
人類基因定序於西元二千年完成,加上電腦科技的進步將基因序列的密碼資訊轉化為蛋白質胺基酸的序列資料庫,而此時的質譜儀配合早期發展的軟性游離化方法,在儀器設計上亦取得重大的突破,二者利用無遠弗屆的網路連接資料庫伺服器與質譜儀所得的原始檔案進行胺基酸序列的比對,形成了名符其實的雲端科技。基因體序列的完成,展開了可供蛋白質發揮的舞台,因為蛋白質的數目多於人類基因的數目,可見為數不少的蛋白質不是藉由人類基因即可確定。後轉譯修飾蛋白質即是其中的一類。
後轉譯修飾是指蛋白質在轉譯之後進行化學修飾,而該修飾的種類繁多,舉凡磷酸化(phosphorylation)、甲基化(methylation)、乙醯化(acetylation)、醣基化(glycosylation),ubiquitination以及sumoylation等等。後轉譯修飾在某一胺基酸的訊息卻無法由基因體所解開的密碼得知,但是後轉譯修飾在生物體內又扮演著重要的角色,例如:細胞間的訊息傳遞,細胞的生長、代謝、分化與細胞凋亡等等。此外,酵素的活化與去活化,可藉由磷酸化與去磷酸化,造成蛋白質結構的差異來調控。所以,如何偵測蛋白質序列上的修飾官能基,進而瞭解該小分子所扮演的角色,在蛋白質體學的研討上是一門非常重要的課題。
而所有的後轉譯修飾中,磷酸化蛋白質體的偵測有其困難度與挑戰性。早期對於磷酸化的實驗方法是使用放射性同位素磷32(32P)來對蛋白質的磷酸根作標定,並配合Edman降解法來找出磷酸化在蛋白質中的位置。但是降解法曠日費時,對於樣品又有純度上的要求。此問題則由串聯式質譜儀的發展而有了解決的契機。但是,利用質譜儀偵測磷酸化蛋白質仍有其困難度,第一是蛋白質存在於細胞內的動態分佈極廣,而且細胞內的蛋白質種類也非常龐大;第二是磷酸化游離氫離子之後易帶負電,而質譜儀的偵測則是以正電偵測;第三則是磷酸化蛋白質的熱不穩定性。
若是已知蛋白質,在已知胺基酸的序列下,為了使質譜儀對於peptide的偵測更有效率,可以將知質荷比(m/z) peptide輸入控制質譜儀的電腦中,一旦偵測到相同的質荷比,即可以強制選擇該離子,進入二次離子的掃描模式中,一來可以避免其他高濃度peptide的干擾,二來可以增加二次離子的訊號強度。質譜儀廠商亦開發出相關的軟體可供使用,如AB SCIEX 的MIDAS與Thermo 的Pinpoint軟體。這二類軟體可以藉由輸入已知蛋白質的序列,推估使用胰蛋白酶消化後並加上磷酸根之後的質荷比,軟體介面如圖一所示。
圖一,將已知蛋白質的胺基酸序列輸入,並選擇消化酵素與後轉譯修飾,軟體將呈現peptide的質荷比。
將所得訊息輸入控制質譜儀器的電腦待以鑑定分析的離子,而實際質譜儀的運作模式如下:樣品經由HPLC管柱持續分離而進入串聯質譜譜進行全掃描分析,而只有符合設定的質荷比分子才會進入後段質譜儀進行碰撞裂解(CID)與子離子掃描,所以,分析的離子只鎖定符合的離子,而將其他非相關離子排除,其分析模式如圖二所示,在質譜儀應用上,該方法名為selected ion monitoring (SIM)。
圖二,selecting ion monitoring的分析模式。第一段質譜只能通過特定質荷比的離子進入第二段質譜進行裂解,第三段質譜再進行子離子的全掃描。
由上述簡略的說明中可得知,蛋白質體的研究發展,涉及到後轉譯修飾,將不僅單靠生物化學家的實驗室進行分析,尚需依賴萃取濃縮的技術(分析方法)、質譜儀器的進步(機電設計)與統整的分析策略(跨領域)。近十年來,蛋白體的研究,已經由定性分析慢慢進入定量分析,藉由早期研究所累積下來眾多具有潛力的蛋白質群體,將開始進行大規模的確效與驗證。所以,能夠分析更稀少的樣品、能縮短時間與減少人力卻得到更多的資訊,將是未來努力的目標。