Enews200 光學技術在生物醫學影像之應用
出自KMU e-News
高雄醫學大學e快報 第200期 研究資源整合發展中心專題
光學技術在生物醫學影像之應用
研究資源整合中心張偉嶠組長
俗話說:「百聞不如一見」。縱然是舌燦蓮花的形容與描述,也遠遠不及具體形像的真實呈現。在生物醫學研究也是如此,十多年前,筆者就讀博士班時,第一次利用離子染劑及高解析螢光顯微鏡,追蹤細胞內離子瞬間波動,透過影像所呈現的微觀生命舞動,至今仍然印象深刻。顯微鏡的發明滿足科學家們「眼見為憑」的好奇天性,讓人類有能力洞悉細胞、細菌、病毒甚至奈米世界。光路設計的日漸成熟、影像敏感度的提高、再搭配上多采多姿的分子(螢光)探針後,光學影像已經成為生醫研究的重要手段。本文將對「共軛焦(Confocal)顯微鏡」、「TIRF 全內反射螢光顯微鏡」、「FRET能量共振轉移技術」、「即時離子影像呈現技術(Real Time Ion imagine)」..等技術做簡單的介紹。
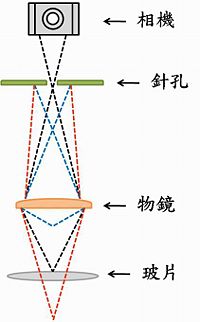
共軛焦(Confocal)顯微鏡: 傳統螢光顯微鏡焦距面較廣,景深也較深,所以螢光會同時發散而進入視野,形成光暈後干擾細部影像的清晰度。為了克服這個問題,顯微鏡在擷取影像時,發展出Pinhole(針孔)來過濾非焦距面的光線,以產生較清晰的螢光影像,這便是共軛焦顯微鏡的基本原理 (Fig 1)。Pinhole設計除了能夠清晰擷取共軛焦平面的影像之外,也能對影像做光切面擷取,累積連續不同深度平面所得影像後,即可建構出立體3D影像。
- Fig. 1
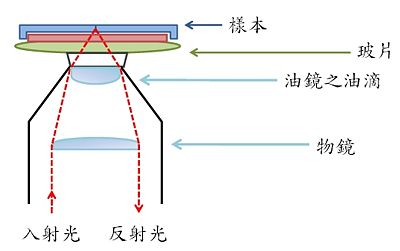
TIRF 全內反射螢光顯微鏡: TIRF 的全名為:Total Internal Reflection Fluorescence。利用光學之全內反射原理: 調整入射角度之雷射光源,配合高孔徑值 (high NA) 之物鏡,當雷射光由物鏡入射至樣本,其入射角度(incident angle)大於臨界角度(critical angle)時,即可讓玻片與為水溶液之交界面發生全內反射現象 (Fig 2A)。利用光學全內反射現象使光源不至於穿透交界面而激發整體樣本 (受激發範圍只距蓋玻片表面厚度不到200 nm)。當待測分子分布於細胞膜時(如:離子通道或受體; Fig 2B),這種技術可以大幅提高影像Z 軸向清晰度。因此,TIRF技術最適用於觀察細胞膜上所發生的生理反應。
- Fig 2A 全內反射之光路
(螢光顯微鏡)
Fig. 2B. Re-distribution of STIM1 in HEK293 cells
(TIRF; data from張偉嶠實驗室)
FRET能量共振轉移技術(Fluorescence Resonance Energy Transfer): FRET是指兩個螢光發色基團在足夠靠近時,當供體分子(donor)吸收一定頻率的光子後被激發到更高的電子能態,在該電子回到基態前,通過偶極子相互作用(dipole-dipole interaction),將能量轉移向鄰近的受體分子(acceptor) 的情形(發生能量共振轉移)。FRET是一種非輻射能量躍遷,通過分子間的電偶極相互作用,將donor激發態能量轉移到acceptor激發態的過程,使donor螢光強度降低,若acceptor亦為發光基團時,則可以發散出更強於本身的螢光強度;因此,以顯微鏡為媒介,利用螢光共振能量轉移的技術,可以量測分子內或是兩分子間的距離,進而了解分子間的摺疊或交互作用。FRET技術已經廣泛地應用於核酸檢測、蛋白質結構…。
即時離子影像呈現技術(Real Time Ion imagine):高解析螢光顯微鏡搭配快速CCD及適當離子螢光染劑後,細胞內離子的波動變可以清楚地被追蹤。舉鈣離子為例:細胞內鈣離子與螢光染劑Fura-2結合時,其激發波長為340 nm,較游離型Fura-2 的激發波長 (380 nm)為短。因此,透過測量兩個激發波長的螢光強度的比例,利用Grynkiewicz公式即可計算出細胞內游離鈣離子的含量。當然,經由改變不同離子螢光染劑,該技術可以應於於K+, Na+, Cl_ ..等離子的偵測。
- Fig 3.Histamine induced store-operated calcium influx in A549 cells.
(Cell Calcium 2011, data from張偉嶠實驗室)
在研究資源整合中心邱式鴻主任的整合規劃,及張慧秋老師、蔡克勵老師、朱家瑩小姐的協助下、細胞分子生物影像核心研究室的雛型已經浮現,2011~2012期間,共辦理五場教育訓練課程,通過confocal認證人數為122人。未來,細胞分子生物影像核心研究室仍需挹注更多的資源,以期提供更全面的研究服務。