Enews223 蛋白體學~鎖定目標蛋白的研究方法
出自KMU e-News
高雄醫學大學e快報 第223期 研究資源整合發展中心專題
蛋白體學~鎖定目標蛋白的研究方法
研究資源整合發展中心 發展企畫組 梁世欣組長
蛋白質體學(proteomics)初始所研究的範疇,擺脫以往針對單一蛋白質的研究方式,轉而探討一群蛋白質彼此之間的交互作用。例如:蛋白質的種類鑑定、加入某一種調控因子之後,蛋白質數量的變化、或是後轉譯修飾(post-translational modification)。
但是,蛋白體學早期因為受限於質譜儀不靈敏,必須利用多維度的分離技術,才能儘量挖掘並鑑定出數量可供分析的蛋白質,目前則因為質譜儀的發展有了長遠進步,在解析度、偵測速度與靈敏度上,都有優異的表現,所以蛋白質鑑定上,已經不再著重於蛋白質鑑定的數量,轉而開始研究特殊的目標蛋白。此類目標蛋白質也涵括利用蛋白體定量技術所找到的生物標誌分子,其後續將進行生物標誌分子的確效(Biomarkers verification)與驗證(Biomarkers validation),都可採用串聯式質譜儀(triple quadruple tandem mass spectrometry)的多重反應監控模式(multiple reactions monitoring, MRM或selected reactions monitoring, SRM)來達成。
利用定量蛋白質體學的方法所找到的生物標誌分子與目標蛋白質,往往成為臨床上疾病判準的選擇,而且若是具有專一性,其重要性更是不言可喻。但是,若要證實與確效該生物標誌物是否為可信賴的分子,生物學上通常是採用西方墨點法(western blotting)或ELISA的作法,利用第一類抗體與抗原(目標蛋白)結合,再利用第二抗體辨識第一抗體。但是,由於抗體價格昂貴、有時甚至沒有抗體或是因為沒有適合操作的抗體(專一性不足),分析過程中可能產生的基質干擾等等因素,限制了西方墨點法與ELISA方法對目標蛋白質的確效結果。
近年來,利用質譜儀開發出「多重反應監控掃描模式」,做為另一種偵測生物標誌分子的手段。此方法目前已經被廣泛利用在小分子檢測上,2011年塑化劑與更早期的中國大陸三聚氰胺毒奶粉事件,利用高效液相層析搭配紫外光/可見光進行的分析,偵測靈敏度約只能至ppm(百萬分之一)的範圍,但是利用高效液相層析質譜儀配合多重反應監控掃描模式,偵測靈敏度可以至ppb(十億分之一)甚至更低(sub-ppb)的濃度,此分析模式目前也開始利用至目標蛋白質的偵測。
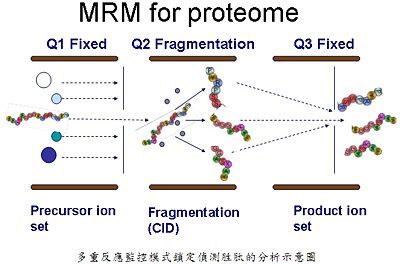
為什麼以串聯式質譜儀,配合多重反應監控掃描模式來找尋目標蛋白(生物標誌分子),可以有較佳的效果與靈敏度呢?不論是小分子或是目標蛋白質,該掃描模式的運作方式均如下圖所示:
多重反應監控模式鎖定偵測胜肽的分析示意圖
利用串聯式質譜儀鎖定生物標誌分子或目標蛋白胜肽(母離子)的質荷比(m/z),只有符合該質荷比的物質方能通過到達下一空間,到達下一空間後,會利用氣體將目標蛋白質的胜肽裂解,該胜肽會裂解成更小片段(子離子),其子離子的質荷比也已知,將之設定成只有特定子離子斷片的質荷比方能夠通過。所以除了滯留時間之外,鎖定特定母離子與特定子離子的質荷比方能有訊號圖譜出現,此方法將大大降低基質干擾,一組特定母離子與子離子的斷片被稱為是一組transition。依小分子定量上的設定,至少需二組transitions才能夠確定,第一組transition是訊號量最高的譜圖,利用來定量;第二組是訊號量第二高的譜圖,是利用來定性確認之用,該方法是目前已知,被用來開拓不同於抗體—抗原免疫染色的定量方式。
雖然一次樣品分析可以進行多組(>1000 MRM transitions)的分析而且非常穩定(具再現性),但是進行驗證確效的樣品數量則是百件甚至千組以上的樣品,具有高通量、快速的分析模式則是目前必須開始面對的難題。依目前轉譯醫學的觀點,希望將基礎研究的成果擴及臨床應用上,但是利用質譜儀器搭配MRM,或許有足夠的靈敏度,但是樣品仍需要前處理方能夠上機,血液檢體取血清、消化並進行某類目標蛋白質的掃描,需要約一天半的工作時間。所以,此類的分析模式除了尋找具有專一性的生物標誌物之外,如何有效縮短樣品前處理的時間,仍有極大的進步空間。